Reaksi Substitusi
Reaksi substitusi adalah suatu
reaksi penggantian gugus fungsional pada senyawa kimia tertentu dengan gugus
fungsional yang lain. Dalam kimia organik, reaksi substitusi elektrofilik dan
nukleofilik merupakan yang paling penting dan banyak digunakan. Reaksi
substitusi organik dikategorikan menjadi beberapa tipe berdasarkan reagen yang
berperan, apakah termasuk nukleofil atau elektrofil. Intermediet yang terlibat
dalam reaksi substitusi dapat berupa karbokation, karbanion, atau radikal
bebas.
Reaksi substitusi terjadi apabila
sebuah atom atau gugus yang berasal dari pereaksi menggantikan sebuah atom atau
gugus dari molekul yang bereaksi. Reaksi substitusi dapat terjadi pada atom
karbon jenuh atau tak jenuh.
a.
Reaksi substitusi nukleofilik
Pada reaksi substitusi
nukleofilik atom/ gugus yang diganti mempunyai elektronegativitas lebih besar
dari atom C, dan atom/gugus pengganti adalah suatu nukleofil, baik nukleofil
netral atau nukleofil yang bermuatan negatif.
b.
Reaksi substitusi elektrofilik
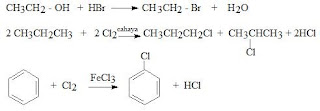
Benzena memiliki rumus molekul
C6H6, dari rumus molekul tersebut benzena termasuk golongan senyawa hidrokarbon
tidak jenuh. Namun ternyata benzena mempunyai sifat kimia yang berbeda dengan
senyawa hidrokarbon tidak jenuh. Beberapa perbedaan sifat benzena dengan
senyawa hidrokarbon tidak jenuh adalah diantaranya bahwa benzena tidak
mengalami reaksi adisi melainkan mengalami reaksi substitusi. Pada umumnya
reaksi yang terjadi terhadap molekul benzena adalah reaksi substitusi
elektrofilik, hal ini disebabkan karena benzena merupakan molekul yang kaya
electron. Ada 4 macam reaksi substitusi elektrofilik terhadap senyawa aromatik,
yaitu :
A. Substitusi Kedua
Suatu benzena dapat mengalami
substitusi kedua, beberapa benzena lebih mudah mengalami substitusi kedua
daripada yang lain. Misal, anilina bereaksi substitusi elektrofilik 1 juta kali
lebih cepat daripada benzena, sebaliknya nitrobenzena bereaksi 1 persejuta laju
benzena.
NH2 dikatakan sebagai
gugus aktivasi, karna adanya gugus ini menyebabkan cincin lebih terbuka
(susceptible) terhadap substitusi lebih lanjut. Sebaliknya, NO2
disebut gugus deaktivasi karna adanya gugus ini menyebabkan cincin lebih
Tertutup terhadap substitusi berikutnya. Keduanya dibandingkan dengan benzena.
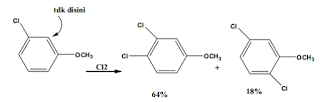
Disamping perbedaan laju, posisi serangan kedua juga
berbeda. Klorobenzena dinitrasi pada posisi orto dan para, tidak pada posisi
meta. Nitrobenzena menjalani Nitrasi kedua pada posisi meta, sangat sedikit
pada posisi orto dan para. Ini menunjukkan Posisi substitusi kedua ditentukan
oleh gugus yg telah ada pada cincin!!
Cl disebut pengarah orto, para sedangkan NO2
disebut pengarah meta
1.
Mekanisme substitusi kedua dg pengarah -o,p
Perhatikan struktur resonansi anilin berikut:
Struktur tresonansi anilin
menunjukkan bahwa gugus NH2 bersifat melepas elektron Secara
resonansi meskipun atom N elektronegatif. Akibatnya cincin menjadi negatif
sebagian dan menarik bagi elektrofil. Semua posisi (o, m dan p) pada cincin
teraktifkan terhadap substitusi elektrofilik tapi posisi o dan p lebih
terkatifkan daripada posisi m
Gugus amino bersama dg -OH, -OR,
-NHCOR dan fenil mengaktifkan cincin terhadap substitusi elektrofilik dengan
cara menyumbang sepasang elektron pada cincin lewat resonansi. Substitusi
terjadi terjadi pada posisi o dan p karena gugus-gugus itu membantu mengemban
muatan positif dalam zat antara (o dan p) ini. Substituen halogen mengarahkan
gugus masuk ke posisi o dan p dengan cara yang sama sepert gugus -NH2
atau –OH. Halogen dapat menyumbangkan elektron-elektronnya dan membantu
mengemban muatan positif dalam zat antara.
Bagaimana dg gugus alkil??
Bukankah gugus alkil tidak punya elektron untuk Disumbangkan? Gugus alkil
melepas elektron dengan cara efek induktif, sehingga kerapatan elektron dalam
cincin tinggi sehingga menarik bagi elektrofil untuk masuk
Gugus alkil mengarahkan elektrofil ke posisi o dan p karena
struktur resonansi berikut:
2.
Mekanisme substitusi kedua dengan pengarah meta
Gugus pengarah meta (NO2
atau COOH) mengemban muatan positif parsial dan tidak menyumbang elektron pada
cincin. Mereka mengurangi rapatan e pada cincin sehingga cincin kurang menarik
bagi elektrofil yang masuk. engarah meta mendeaktivasi semua posisi dalam
cincin (sama sepert orto dan para), hanya saja deaktivasi meta lebih kecil.
Kenapa?? Karena deaktivasi oleh orto dan para didestabilkan oleh dua muatan
positif yang berdekatan sedangkan meta tidak.
B. Substitusi Ketiga
Bagaimana bila sebuah cincin
benzena telah mempunyai dua substituen?
1.
Jika dua substituen itu mengarahkan suatu gugus
masuk ke satu posisi maka posisi ini akan merupakan posisi utama substitusi
ketiga
2.
Jika dua gugus bertentangan efek pengarahan
mereka, maka aktivattor yg lebih kuat yg lebih diturut
3.
Jika dua gugus deaktivasi berada pada cincin,
terlepas dimana posisi mereka, dapat menyukarkan substitusi ketiga
4.
Jika dua gugus pada cincin berposisi meta satu
sama lain, biasanya cincin itu tidak menjalani substitusi pada posisi yg mereka
apit meskipun mungkin cincin itu teraktifkan pada posisi itu. Hal itu agaknya
disebabkan halangan sterik.
Sumber
Fessenden, R. J dan J. S. Fessenden. 1986. Kimia Organik Edisi 3. Jakarta: Erlangga.
Hart, H. 1990. Kimia
Organik: Suatu Kuliah Singkat. Jakarta: Erlangga.
Griffin, R. W. 1969. Modern Organic Chemistry. Tokyo: McGraw-Hill Inc.
Permasalahan :
1. Mengapa alkilasi Friedel-Craft tidak dapat
diterapkan pada cincin aromatik yang telah mempunyai gugus-gugus asam nitro
atau asam sulfonat ?
2. Biasanya, suatu senyawa yang memiliki ikatan
rangkap mudah mengalami reaksi adisi,tetapi pada benzene malah sebaliknya,
ternyata benzena sukar mengalami reaksi adisi dan justru lebih mudah mengalami
reaksi substitusi. Mengapa demikian ?
3. Tidak seperti reaksi substitusi elektrofilik
benzena yang lain , ion benzenonium antara dalam sulfonasi dapat kembali ke
benzena atau terus ke asam benzena sulfonat dengan hampir sama mudahnya, juga
laju-laju reaksi tahap 1 dan 2 saling berdekatan besarnya daripada untuk reaksi
substitusi elktrofilik yang lain. Berdasarkan data diatas apakah sifat yang
dimiliki reaksi sulfonasi ??
4. Bagaimana menentukan suatu gugus fungsi apakah itu pengarah orto, para atau meta?
4. Bagaimana menentukan suatu gugus fungsi apakah itu pengarah orto, para atau meta?















12 komentar:
Materi yang menarik Habib, menurut saya untuk pertanyaan no 2, benzena lebih mudah mengalami reaksi substitusi dibandingkan adisi dikarenakan adanya ikatan rangkap terkonjugasi yang menyebabkan benzena mengalami resonansi. sehingga pemutusan ikatan rangkap lebih sulit untuk terjadi, dibandingkan substitusi oleh gugus lain.
materi yang sangat menaraik, saya akan menjawab pertanyaan nomor 1 diamana dengan adanya gugus asam nitro/asam sulfonat pada cincin aromatik akan menyebabkan terbentuknya kompleks dengan katalis yaitu aluminium klorida yang menyebabkan tidak aktifnya katalis.
Terimakasih atas materi yang habib sampaikan semoga bermanfaat untuk kita semua:)
Saya akan menjawab pertanyaan yang kedua, dimana senyawa yang memiliki ikatan rangkap mudah mengalami reaksi adisi, tetapi pada benzena lebih mudah mengalami reaksi subtitusi. Hal ini dikarenakan pada benzena memiliki ikatan rangkap terkonjugasi yang akan menyebabkan resonansi. Adanya resonansi tersebut yang maka proses delokalisasi akan terus berlangsung sehingga sulit untuk memutuskan ikatan rangkap nya yang memiliki kestabilan pada cincinnya sehingga dimungkinkab akan terjadi reaksi subtitusi daripada adisi. Terimakasih
Hai Habib. Saya akan menjawab pertanyaan anda yang kedua, menurut saya Benzen lebih mudah mengalami reaksi substitusi dikarenakan adanya resonansi yang menstabilkan ikatan rangkap terkonjugasi pd benzen sehingga suatu cincin benzen tidak mudah diputus secara adisi melainkan hanya lebih mudah tersubstitusi oleh gugus lain
terimakasih
Terimakasih penjelasannya habib, sangat bermanfaat
Disini saya akan mencoba menjawab pertanyaan yang diajukan
2. Benzena lebih mudah mengalami reaksi subtitusi. Hal ini dikarenakan pada benzena memiliki ikatan rangkap terkonjugasi yang akan menyebabkan resonansi. Adanya resonansi tersebut yang maka proses delokalisasi akan terus berlangsung sehingga sulit untuk memutuskan ikatan rangkap nya yang memiliki kestabilan pada cincinnya sehingga dimungkinkab akan terjadi reaksi subtitusi daripada adisi.
Terimakasih :)
Terimakasih habib
Untuk pertanyaannya
4. Penentukan suatu gugus fungsi apakah itu pengarah orto, para atau meta yaitu berdasarkan sifatnya
Gugus aktivator akan mengarahkan pada orto dan para dimana posisi ini akan menjadi paling stabil akibat karbokation akan berada pada posisi tersier
Sedangkan gugus deaktivasi akan memposisikan pada meta akibat kestabilan berada pada meta yang sekunder. Karbokation posisi orto dan para akan berada dekat dengan substituen positid jga sehingga kestabilan kedua posisi ini lebih rendah dari meta
Sekian :)
disini untuk pertanyaan keempat dimana posisi fungsi orto meta dan para dapat dilihat dari subtituen pertama yang menjadi patokannya dan untuk pertanyaan kedua dimanaa resonansi pada cincin aromatik sangat sulit mengalami adisi sehingga lebih mungkin untuk reaksi subtitusi
terima kasih atas materinya, menurut saya jawaban pertanyaan no 2 yaitu senyawa aromatik ebnzena memiliki ikatan rangkap terkonjugasi sehingga delokasi sasi elektron terjadi sangat baik yang menyebabkan adanya resonansi yang membuat benzene sangat stabil sehingga sulit untuk dilakukan pemutusan salah satu ikatan rangkap menjadi ikatan runggal yang membutuhkan energi yang sangat besar, sehingga rekasi yang terjadi pada benzena adalah reaksi substitusi
Baiklah saya akan mencoba menjawab pertanyaan saudara Habib untuk pertanyaan yang kedua dimana benzena lebih mudah mengalami reaksi substitusi dibandingkan adisi dikarenakan adanya ikatan rangkap terkonjugasi yang menyebabkan benzena mengalami resonansi. sehingga pemutusan ikatan rangkap lebih sulit untuk terjadi, dibandingkan substitusi oleh gugus lain.
terima kasih atas materinya, menurut saya jawaban pertanyaan no 2 yaitu senyawa aromatik ebnzena memiliki ikatan rangkap terkonjugasi sehingga delokasi sasi elektron terjadi sangat baik yang menyebabkan adanya resonansi yang membuat benzene sangat stabil sehingga sulit untuk dilakukan pemutusan salah satu ikatan rangkap menjadi ikatan runggal yang membutuhkan energi yang sangat besar, sehingga rekasi yang terjadi pada benzena adalah reaksi substitusi
Terimakasih habib, mnrt pertanyaan no 2 yaitu senyawa aromatik ebnzena memiliki ikatan rangkap terkonjugasi sehingga delokasi sasi elektron terjadi sangat baik yang menyebabkan adanya resonansi yang membuat benzene sangat stabil sehingga sulit untuk dilakukan pemutusan salah satu ikatan rangkap menjadi ikatan runggal yang membutuhkan energi yang sangat besar, sehingga rekasi yang terjadi pada benzena adalah reaksi substitusi
Saya akan menjawab no 2 menurut saya reakdi adisi tidak dapat terjadi karena senyawa aromatik mengalami resonansi sehingga lebih stabil dan sulit mengalami reaksi adisi
Post a Comment